¹ Э. Васкес, ² О.И. Шубравый
Московский государственный университет им. М.В. Ломоносова ¹, Московский зоопарк ²
Выращивание личинок морских рыб в лабораторных условиях до настоящего времени является сложной проблемой. Как правило, личинки морских рыб значительно меньше по размеру, чем личинки пресноводных рыб и имеют более продолжительный период пелагического существования. Кроме того, они нуждаются в более специализированной пище.
Большая требовательность личинок морских рыб к качеству воды ещё более усложняют проблему. Тем не менее, получены определённые успехи в выращивании личинок некоторых видов промысловых рыб, камбалы калкана в Институте биологии южных морей, кефали на биостанции Большой Утреш и некоторых видов черноморских бычков. Любителям морского аквариума Д. Степанову и Д. Астахову удалось освоить методики разведения нескольких видов рыб клоунов[1].
Сложности в выращивании личинок были преодолены наличием больших морских аквариумов ёмкостью более 1 т, неограниченным количеством чистой морской воды и возможностью кормления личинок собранным в море и сортированным по размеру планктоном. В лабораториях, удалённых от моря, создать такие условия развивающимся личинкам очень сложно.
Существуют два способа выращивания личинок морских рыб в удалённых от моря лабораториях. Это использование больших аквариумов (иногда до 1000 литров) и ёмкостей, подключенных к системам регенерации воды (Шубравый, 1983), использование небольших аквариумов объёмом 50 л по методике "зелёный водоем". В обоих случаях применение искусственной морской воды (Шубравый, 1983) даёт более хорошие результаты, так как она практически стерильна и не содержит вредных загрязнений.
При первом способе возникает проблема защиты личинок от засасывания их в систему фильтрации, а также создания необходимой концентрации корма: защитить личинок от попадания в систему регенерации воды может завеса из пузырьков воздуха, создаваемая трубой, перфорированной через каждые несколько сантиметров, уложенной по периметру аквариума. Труба подключается к воздушной магистрали (Haude и Ramsay, I972).
Хорошие результаты даёт медленное вращение цилиндрической сетки, установленной на водозаборе. Скорость протока воды через аквариум с личинками подобрана так, что за двое суток обеспечивается полная смена воды. При любом способе выращивания аквариум с личинками должен быть со всех сторон закрыт чёрной бумагой или пластмассой и иметь слабое верхнее освещение, что делает корм более заметным для личинок и предохраняет их от стресса (Marliave, I976).
При использовании метода "зелёный водоём" тщательно вымытый цельностеклянный аквариум из оргстекла заполняют чистой морской водой. В воду добавляют необходимые питательные вещества из расчёта среды Гольдберга 1мл/л 2 и 3 раствора и 2 мл/л 1 раствора (см. далее).
Для стимуляции роста водорослей, аквариум ярко освещается - 2000 люкс. В аквариум вносится культура водорослей. Растущие микроводоросли кондиционируют воду, выполняя функцию биологического фильтра, и утилизируют метаболиты личинок, выделяя в воду витамины и фитогормоны, стимулирующие развитие личинок. Аквариум с водорослями должен быть задействован за несколько дней до выклева личинок. В качестве регенераторов используют следующие микроводоросли: Dunaniela tertiolekta, Platimonas viridis, Monohrisis goldbani, Izohrisis sp, Phelodaktilum trikornutum.
Лучшие результаты получаются при использовании смешанных культур водорослей. При всех способах выращивания личинок пересаживают в новый аквариум, оснащенный системой регенерации, только после метаморфоза, когда они способны противостоять току воды, затягивающего их в систему фильтрации.
В качестве объекта для отработки методов выращивания личинок морских рыб нами была выбрана морская собачка Salaria(Blennius) pavo (рис. 12 цв. вкл.). Этот вид широко распространен вдоль Черноморского побережья Крыма, неприхотлив, хорошо живёт в неволе и часто нерестится в аквариуме. Одного самца и двух самок S. pavo содержали в 200-литровом морском аквариуме, оборудованном системой регенерации, при температуре воды 23-25°С и рH 8-8,3, уровень нитрата составлял 50-100 мг/л. Кладка икры была обнаружена в сентябре 1986 года в большой раковине. Так как самец активно ухаживал за икрой, удаляя неоплодотворённые и неразвивающиеся икринки, кладку забрали через неделю после нереста. Для искусственной инкубации икры раковина с кладкой была помещена в цилиндрический стеклянный сосуд объёмом 10 л. Для аэрации тока воды на высоте 1 см над кладкой была установлена стеклянная трубка диаметром 4 мм, подключённая к воздушному компрессору. Выход личинки из икры наблюдался через 225-235 часов после нереста. Выклюнувшуюся личинку отлавливали при помощи сифона и пересаживали в личиночный культиватор. В качестве последнего использовали цельностеклянный сосуд объёмом 10-15 литров, освещённый сверху двумя люминесцентными лампами по 20 ватт. Стенки сосуда с внешней стороны были покрашены в черный цвет. Небольшой не закрашенный участок оставили для наблюдений. Ток воды в сосуде создавали с помощью мешалки, соединенной с двигателем, вращающим её со скоростью 0,5-1,5 оборота в минуту. На ось двигателя одета пластмассовая трубка, на противоположном конце которой приклеена под углом 30° круглая пластмассовая пластина диаметром 60 мм. При вращении оси пластина совершает колебательно-вращательное движение и тем самым обеспечивает хорошее перемешивание воды. Пластина вращалась на расстоянии 6 см от дна. Перед помещением личинок в воду добавляли культуры микроводорослей.
Концентрация водорослей поддерживалась на уровне 2х106 кл/мл путем ежедневного добавления смеси культур. В качестве стартового корма для личинок использовалась коловратка Brachionas plicatilis.
Плотность коловратки в культиваторе с личинками поддерживали на уровне 10-20 экз. на мл. Через неделю личинок перевели на кормление науплиями Artemia salina. В месячном возрасте личинки прошли метаморфоз и опустились на дно. Ювенильные особи были помещены в аквариум объёмом 100 л с системой регенерации воды. Прошедших метаморфоз мальков кормили мотылем. Во время выращивания личинок воду в культиваторе ежедневно подменивали на 20-30%: со дна удаляли экскременты и накопившийся детрит. Выживаемость личинок до метаморфоза составила около 50%.
Кормление личинок
Основные трудности в выкармливании личинок морских рыб заключаются в подборе необходимых кормов. В качестве корма используются коловратки, копеподы, инфузории, личинки двухстворчатых моллюсков и усоногих раков. Применение нетрадиционных кормов, таких, как варёный куриный желток, гомогенаты моллюсков и мяса и т.д. не даёт желаемых результатов, и сильно загрязняют воду.
В качестве стартового корма для личинок солоновато-водную коловратку Brachionus plicftilis. Существует целый ряд работ по культивированию этого вида (Спектрова и др., 1986).
Выживание при широком диапазоне температур (14-36°С) и солёности (10-40 рр), слабая восприимчивость к загрязнениям метаболитами делает эту коловратку незаменимым кормом при лабораторном культивировании.
Выращивать коловратку можно в различных культиваторах. Хорошие результаты получены нами при использовании специального культиватора. Он изготовлен из оргстекла толщиной 6 мм. Подача воздуха сбоку обеспечивает хорошую аэрацию и перемешивание культуры. Центральный слив расположен в месте максимальной концентрации коловратки. Культиватор круглосуточно освещается 4 люминесцентными лампами мощностью 20 ватт для стимулирования роста микроводорослей. Культиватор термостатируется при помощи контактного термометра, электронного реле и нагревателя. Оптимальная температура для максимальной продуктивности -28-32оС.
Культиватор лучше заполнять свежеприготовленной морской водой во избежание заноса инфекции к личинкам рыб. В качестве корма для коловратки лучше использовать микроводоросли, т.к. сама коловратка выступает в роли "удобной упаковки" для микроводорослей и от того, чем "наполняют" коловратку и зависит успех при выращивании личинок морских рыб. Мы кормили коловратку смесью водорослей Plathimonas viridis, Pavlovo luthari, Pheladactylum tricarnutum, Dunaliella tertiolekta.
Хорошие результаты получаются при кормлении коловратки смесью Pavlovo luthari с Izohrisis goldbani в соотношении 1:1. Необходимо следить, чтобы в культиваторе всегда была пища для коловратки. Отсутствие корма может привести к потере культуры. Для сохранения культуры мы использовали следующий способ. Интенсивную культуру коловратки помещали в литровую коническую колбу объемом 600 мл, туда же добавляли смесь микроводорослей - 300 мл, и хранили в холодильнике. Первые 1-2 недели регулярно перемешивали и при необходимости добавляли микроводоросли. В дальнейшем при уменьшении плотности культуры коловраток хранили без перемешивания при T= +4°С до 1 года. Попав в неблагоприятные условия (понижение температуры в нашем случае) коловратки переходят на половой способ размножения и дают миктические яйца, оседающие на дно. Яйца сохраняют способность к развитию в течение нескольких лет. При помещении в культиватор через 7-12 дней из яиц выводятся коловратки. Добавление суспензии микроводорослей и круглосуточное освещение стимулирует выклев.
Основой успеха при выкармливании личинок морских рыб является культивирование одноклеточных водорослей различных видов в необходимом количестве. Обычно микроводоросли выращивают в колбах или бутылях установленных у окна, или на специальных световых стеллажах (Smith W.L., M.H. Chanley, 1975). При кажущейся простоте такой способ выращивания требует больших затрат труда, больших площадей и выход микроводорослей для кормления очень низкий, плотность суспензии мала.
Лучшие результаты получаются при использовании специально сконструированных культиваторов трубчатого типа. Однако это, как правило, большие полупромышленные культиваторы.
Для лабораторного культивирования микроводорослей наиболее удобным оказался цельностеклянный плоскопараллельный культиватор ёмкостью около 2 литров (рис. 1). Культиватор изготовлен из силикатного стекла толщиной 3-4 мм, склеенного силиконовым клеем. Коническое дно культиватора не дает возможности микроводорослям оседать при барбатаже[2] и обеспечивает хорошее перемешивание суспензий. Барбатаж суспензии микроводорослей обеспечивается воздухом с 3% добавкой углекислого газа для получения более интенсивного роста. Воздух в культиватор подаётся через стеклянную микропипетку, установленную в центре конического дна культиватора и подсоединённую с помощью силиконовой трубки к магистрали воздуха. Толщина слоя суспензии микроводорослей около 10 мм является оптимальной для полного использования светового потока осветительных ламп. Для термостатирования используется кассета, склеенная из стекла толщиной 5 мм, в которой установлены 5 культиваторов микроводорослей и змеевик охлаждения из медной трубки диаметром 10 мм. Кассета предварительно заливается дистиллированной водой с добавкой медного купороса для предотвращения развития в ней микроводорослей. В змеевик охлаждения через электромагнитный клапан подаётся водопроводная вода. Датчиком температуры является контактный термометр, который через электронное реле управляет электромагнитным клапаном подачи воды. В качестве осветителя используются 2 лампы типа ДРИ-400 или ДнАТ-400 с пускорегулирующим устройством, смонтированным на отдельной раме со стеклянными параболическими отражателями. Отодвигая или приближая раму с лампами от культиватора, можно менять интенсивность светового потока. Система воздухоподачи состоит из воздушного компрессора, баллона с углекислым газом и редуктора, двух ротаметров, измеряющих скорость подачи воздуха и углекислоты и системы шлангов с регулирующими кранами.
Перед работой культиваторы тщательно промывают и заполняют стерильной морской водой. Для стерилизации морскую воду, взятую из аквариума, пропускают через милипоровый фильтр. Лучшие результаты получаются при температурной стерилизации путём троекратного нагрева до 80°С. В воду добавляют среду Гольдберга (раствор I: KNO3 10,1г на 100 мл H2O distill.; раствор II: Na2HPO4 1,42г на 100 мл H2O; раствор III: FeCl3*6H2O 27,03 мг; MnCl2*4H2o 19,78 мг; CoCl2*6H2O 23,79 мг на 100 мл H2O; на 1 литр морской воды вносят растворы: I – 2мл; II – 05 мл; III – 1мл) и вносят микроводоросли. Интенсивность света при запуске культиватора должна быть порядка (5-7) х 103 люкс. По мере нарастания плотности культуры интенсивность освещения увеличивают до (20-50) x I03 люкс. Интенсивность барботажа подбирают таким образом, чтобы суспензия микроводорослей не выплёскивалась из культиватора. При прекращении роста культуры необходимо заменить 25-30% суспензии свежей средой с добавлением двойной среды Гольдберга. Следующую подмену сделать тройной средой и в дальнейшем подменивать тройной средой.
Для автоматизации процесса выращивания микроводорослей и получения возможности определения оптимальных значений рН нами был изготовлен культиватор рН-стат. В нём был реализован эффект увеличения рН среды по мере роста водорослей. Культиватор рН-стат (рис. 2) состоит из реактора, снабжённого патрубком перелива. В реакторе расположены змеевик охлаждения из нержавеющей трубы диаметром 8 мм, электроды рН метра, контактный термометр, магнитная мешалка, осветителя, состоящего из лампы типа ДРИ 400 или ДКАТ400 с пускорегулирующим устройством и стеклянного параболического отражателя обеспечивающего световой поток до 60x1000 люкс.
Система рН стабилизации состоит из рН-метра (рН 340) с блоком датчика, автотитратора БAT 15, электромагнитного клапана и бытового сифона.
Система термостатирования состоит из контактного термометра электронного реле и электромагнитного клапана.
Культиватор работает следующим образом: по мере роста микроводорослей в реакторе рН среды начинает увеличиваться от 8 до 9,5-10 рН. На автотитраторе выставляется необходимое значение рН. При достижении рН среды этого значения, автотитратор включает на короткое время электромагнитное реле, которое, в свою очередь, включает электромагнитный клапан. Порция газированной воды из сифона поступает через клапан в реактор и снижает рН суспензии микроводорослей, разбавляет её и снабжает углекислым газом. Излишек суспензии сливается в приёмник или в культиватор коловратки, что и позволяет автоматизировать процесс кормления коловраток.
Описанным выше способом было получено разведение от других видов Черноморских собачек рода Salaria (Blennius) - S. sphynx, S. zvonimiri, S. tentacularis.
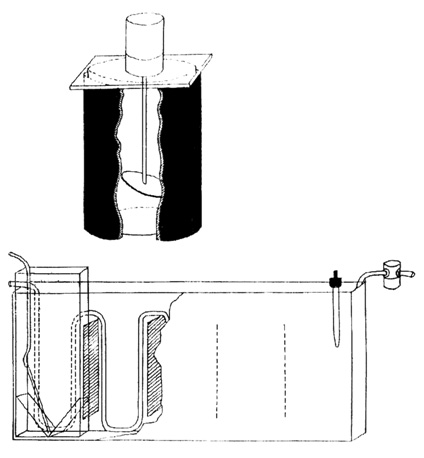
Рис. 1. Культиватор микроводорослей лабораторный
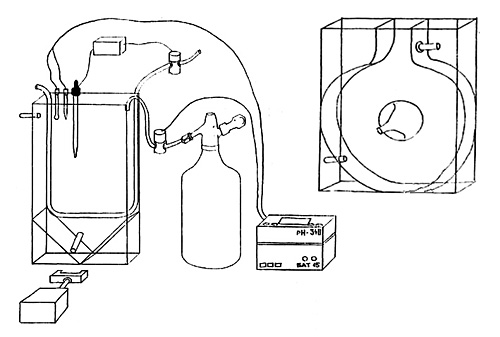
Рис. 2. Культиватор микроводорослей рН-стат
[1] Смотрите серию публикаций Д.А. Астахова, С.Ю. Попонова и В.Р. Попоновой в сборниках «Научные исследования в зоологических парках» (прим. ред.).
[2] Барбатаж – пропускание пузырьков воздуха через толщу воды (прим. авт.).

 Морские рыбки
Морские рыбки
 Пресноводные рыбки
Пресноводные рыбки
 Террариумные животные
Террариумные животные
 Аквариумы и тумбы
Аквариумы и тумбы Каталог товаров
Каталог товаров Терарриумы
Терарриумы