М.Ю. Колобов (Московский государственный университет им. М.В. Ломоносова, ООО «Аква Лого», Москва)
Одной из самых важных проблем, которые неизбежно возникают при создании аквариумной системы, является перенаселенность и дефицит пространства. В аквариуме по вполне понятным причинам весьма сложно, а, зачастую, и практически невозможно поддерживать ту плотность гидробионтов, при которой они существовали в течение миллионов лет эволюции в природных условиях. Для морских бентосных организмов объем жизненного пространства может исчисляться десятками кубических метров воды на одну особь. Для пресноводных гидробионтов этот объем значительно ниже, но все равно намного превышает возможности аквариумистов. Возникающие при перенаселенности аквариума проблемы могут привести к нарушению и дальнейшему разрушению биологического равновесия аквариума, а также гибели рыб и других гидробионтов.
Однако в процессе эволюции многие растения и животные выработали разнообразные способы снижения отрицательного воздействия перенаселенности и задействуют их в тех или иных условиях (Бурковский и др., 1997; Колобов и др., 2002; Колобов, Бурковский, 2002а; Колобов, Бурковский, 2002b). Для аквариумиста весьма важно знать эти способы и, возможно, изначально смоделировать их при создании аквариумной системы, тем самым снизив риск вредного воздействия на нее высокой плотности гидробионтов.
Итак, ПЕРЕНАСЕЛЕННОСТЬ АКВАРИУМА или сверхвысокая плотность популяции отдельного вида в природе. Что общего и что делать?
А) Расхождение в пространстве моллюсков при высокой плотности популяции.
Самым простым способом для животных решить проблему высокой плотности - это разойтись со своими сородичами в пространстве, занять определенную территорию и защищать ее в течение всей жизни. В результате формируется однородное распределение организмов в пределах занимаемой территории. Данный способ эффективен лишь до определенной плотности организмов, когда каждый индивидуальный участок территории способен поддерживать существование одного животного (рис.1).
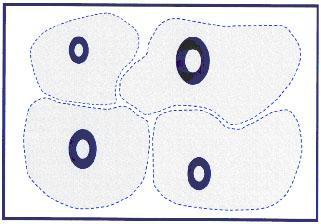
Рисунок 1. Равномерное распределение
Когда же количество организмов возрастает до плотности, близкой к предельной емкости среды, индивидуальные территории начинают перекрываться и животные начинают конкурировать за доступные ресурсы (территорию, пищу, полового партнера и др.), а избежать этого с помощью миграции невозможно (что особенно ярко проявляется в аквариуме), включаются особые механизмы снижения внутривидовой конкуренции. При этом в пространственном распределении организмов возникает неоднородность периодического характера, вследствие активного перераспределения организмов или их смертности, сложных типов нелинейных динамик, например, локальная динамика типа Олли (Allee, 1951) или ограниченной миграции (Свирежев, 1987).
Нами исследовались литоральные популяции двустворчатых моллюсков Macoma balthica, Macoma calcarea и брюхоногого моллюска Hydrobia ulvae (Кандалакшский залив, Белое море). Для каждого из видов показано, что при критической плотности особи одного вида, имеющие наиболее близкие размеры, стараются максимально возможно разойтись в доступном пространстве, в то время как их ближайшими соседями обычно оказываются особи, которые отличаются с ними по линейным размерам тела в среднем в 1,5 раза. Ранее американским экологом Хатчинсоном было показано, что расхождение по массе в 2 раза, а по линейным размерам тела (длине) в 1,2 раза является одним из эффективных способов снижения конкуренции за пищевой ресурс при совместном существовании (Hutchinson, 1959). В результате суммирования всех возможных вариантов пространственной дифференциации отдельных размерных групп образуется структура, названная нами «корреляционная волна». Например, если весь размерный диапазон моллюсков, от самых крупных до самых мелких, условно разделить на семь групп, то произвольно выбранная IV размерная группа будет иметь следующую изменяющуюся корреляцию частот распределения: отрицательную с I группой (r = –0,08), положительную со II (r = +0,3), отрицательную с соседней III (r = –0,27), отрицательную также с соседней V (r = –0,22), положительную с VI (r = +0,3), и, наконец, отрицательную с VII размерной группой (r = –0,11) (рис.2).
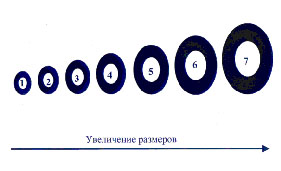
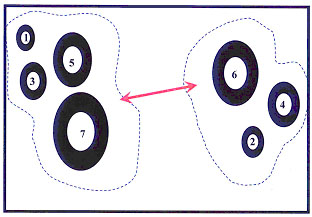
Рисунок 2. Распределение «Корреляционная волна»
Волны корреляций устойчивы на протяжении значительного размерного диапазона моллюсков. Они почти не меняют своей амплитуды и частоты практически до 2-кратной разницы линейных размеров раковин моллюсков, хотя за этот период совершается множество корреляционных колебаний (рис.3). Результатом такого распределения является минимизация пространственного перекрывания близких по размерам особей как наиболее вероятных конкурентов.
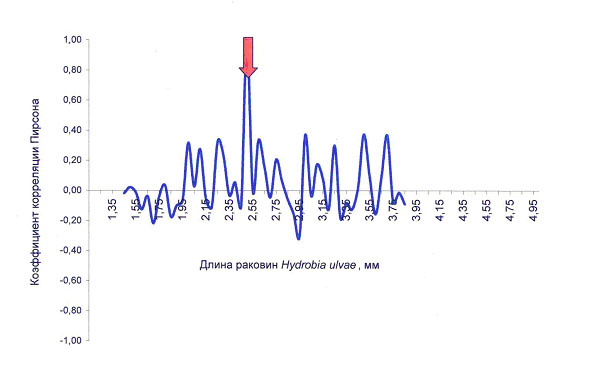
Рисунок 3. Волны корреляций размеров раковин H.ulvae
Б) Формирование размерной гребенки.
Однако при очень высокой численности животных пространственно-размерная дифференциация не обеспечивает приемлемо низкого уровня внутривидового взаимодействия. Исследования размерной структуры популяции моллюска H. ulvae в местах их очень высокой численности (до 40 тыс. экз./м2) позволили выявить дополнительные способы оптимизации внутривидовых отношений. Одним из них стало самоизреживание размерной структуры моллюсков.
Конечным результатом процесса самоизреживания, как видно из рисунка, является чередование высоких и низких численностей последовательных размерных групп (рис.4). Такая структура намного уменьшает саму вероятность контакта особей близкого размера на данной территории, а значит, и соперничество за доступные ресурсы минимизировано.
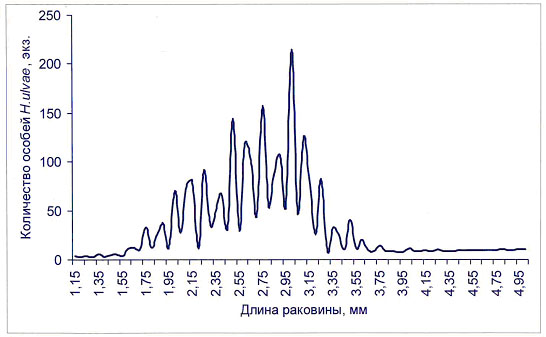
Рисунок 4. Чередование численностей размерных групп H.ulvae
Любая комплексная система, состоящая из взаимодействующих компонентов с напряженными связями, крайне неустойчива, и малейшая неоднородность ее структуры приводит к возникновению флуктуаций во всей системе (Свирижев, 1987). Часто это порождает возникновение, в разной степени устойчивой, структурной неоднородности – автомодельных волн (Колмогоров и др., 1937; Fisher, 1937). В нашем случае после достижения критического предела плотности организмов, близкого к емкости среды в микропространстве, возрастающая конкуренция за пищевой ресурс между особями гидробии близкого размера приводит к угнетению и, минимум, к отставанию в росте какой-то части из них (например, более молодых или зараженных паразитами моллюсков) до тех пор, пока различие в размерах тела не обеспечит достаточное расхождение в спектре потребляемой пищи. Миграция гидробий из этого района (как способ снижения плотности) практически исключена, поскольку изучаемый локус популяции H. ulvae со всех сторон окружен участками литорали с аналогичной плотностью этих моллюсков. «Сдвиг» размеров депрессивных особей в более молодые размерные группы вызывает в последних аналогичный процесс диссипации размеров. Более высокая смертность отстающих в росте особей также будет увеличивать интервал между соседними размерными группами моллюсков. Каждую такую группу будут составлять гидробии близкого размера в количестве, которое обеспечивает отсутствие конкуренции за пищу. В результате вышеописанных процессов формируется бегущая волна Колмогорова-Петровского-Пискунова, которая распространяется на весь размерный диапазон особей H. ulvae, присутствующих на данной территории. Возникающий эффект самоизреживания популяции приводит к тому, что близких по размеру особей просто не существует или их очень мало. Это уменьшает вероятность соперничества между организмами, обитающими в одной точке пространства. Амплитуда и длина волны самоизреживания зависят от емкости среды, плотности организмов, а также степени перекрывания организмов по пище и интенсивности ее потребления.
Формирование самоизреженной структуры происходит не сразу. Для моллюсков H. ulvae, которые живут 3-4 года, показано, что явно оно проявляется только на втором году жизни.
Подводя итог анализу микропространственного распределения указанных видов, следует подчеркнуть, что оно в каждом случае отражает особенности регуляции системы на всех уровнях, приводящей к ее упорядочению и наиболее полному использованию ресурсов среды.
В некоторых случаях и такие меры недостаточны для бесконфликтного существования животных при дефиците пространства, поэтому если появляются дополнительные возможности избежать конкуренции, они реализуются.
В) Влияние сверхвысокой плотности посадки личинок Xenopus laevis на скорость их метаморфоза.
Такой дополнительной возможностью является метаморфоз для животных, имеющих несколько стадий развития, особенно если эти стадии обитают в разных природных средах. Например, вода - суша (для амфибий), вода - воздух (для насекомых) или если стадии характеризуются разными типами питания (например, фильтрация - хищничество (в частности, для шпорцевых лягушек).
Эксперимент по влиянию сверхвысокой плотности на скорость метаморфоза проводили в лабораторных условиях в течение трех месяцев. В качестве объекта исследований использовалась оплодотворенная икра шпорцевой лягушки X. laevis.
После вымета самкой икра была собрана и помещена в отдельные емкости в количестве по 50 шт. Всего в эксперименте использовалось 3 емкости объемом по 2 л, которые в течение всего эксперимента находились под лампами дневного света в течение 10-12 часов и температуре 26-28˚ С.
Показано, что в данных условиях развитие головастиков идет неодинаково. Уже через 2-3 недели образуются три независимые линии филогенетического развития.
1. Наиболее динамично развивающейся является немногочисленная группа гигантских каннибальных морф. Особи этой группы растут быстрее других головастиков, достаточно быстро достигая размеров 5-6 см. Тип питания быстро сменяется с растительноядного на плотоядный. Значительную долю рациона этих головастиков составляют более мелкие собратья. Яркой особенностью филогенетического развития данной группы является тот факт, что скорость метаморфоза головастиков замедляется на стадии образования зачатков задних ног и даже по прошествии 3 месяцев значительных изменений не наблюдается.
2. Основную долю от общего числа головастиков составляет депрессивная группа. Особи этой группы отстают в развитии и не достигают крупных размеров. На протяжении всего периода исследований их размер остается в пределах 1,5-3 см. Тип питания особей этой группы преимущественно растительноядный, по мере взросления добавляется хищничество. Именно такие головастики являются объектом хищничества со стороны собратьев-каннибалов. Их метаморфоз замедлен, но постоянен – у большинства выживших головастиков, в конце концов, появляются как задние, так и передние ноги.
3. И, наконец, третью немногочисленную группу головастиков составляют особи, у которых скорость метаморфоза необычайно высока. Для сравнения можно сказать, что у таких головастиков формируются задние и передние ноги, а хвост укорачивается (т.е. метаморфоз практически подходит к концу), когда у особей других групп задние ноги только формируются. Стоит отметить, что данная группа вычленяется из депрессивной группы, поэтому маленькие лягушата имеют небольшие размеры, а дефицитная пища расходуется не на рост, а преимущественно на метаморфоз.
Таким образом, мы видим, что при дефиците пространства головастики шпорцевой лягушки пытаются максимально разойтись в спектре потребляемых ресурсов, занимая специфическую экологическую нишу, тем самым снижая конкуренцию со своими сородичами. Приблизительное процентное соотношение выделяемых групп по численности было 20:60:20, где максимальное значение принадлежит депрессивной группе. Выявленную особенность развития можно считать дополнительной стратегией сохранения жизнеспособности популяции в условиях дефицита пространства.
В заключение необходимо отметить, что подобные неоднородности жизненных циклов пространственного распределения, направленные на снижение внутрипопуляционной конкуренции, обычны для животного мира (Andrewatha, Birch, 1954; Hutchinson, 1967; Bonney, 1975; Masing, 1981) и могут распространяться также и на динамику воспроизводства (Kaitala et al., 1996). Иными словами, чем больше плотность организмов, тем сильнее подавляется половое поведение. Репродуктивно активным остается только малый процент от общего количества животных, что важно понимать аквариумистам, особенно занимающимся разведением рыб.
Литература:
- Бурковский И.В., Столяров А.П., Колобов М.Ю., 1997. Пространственная гетерогенность структуры макробентоса песчано-илистой литорали Белого моря // Успехи совр. биол. Т.117. Вып.4. С.446-479.
- Бурковский И.В., Столяров А.П., Колобов М.Ю., 2002. Пространственная организация и функционирование морской (эстуарной) прибрежной экосистемы // Успехи совр. биол. Т. 122. Вып.4. С. 316-325.
- Колмогоров А.Н., Петровский И.Г., Пискунов Н.С., 1937. Исследование уравнения диффузии, соединенной с возрастанием количества вещества, и его применение к одной биологической проблеме.// Бюлл. МГУ. Сер. А. № 6. С.1-26.
- Колобов М.Ю., Бурковский И.В., Удалов А.А., Столяров А.П., 2002. Пространственная организация и экологическая стратегия популяций Priapulus caudatus и Halicryptus spinulosus (Priapulida) в условиях синтопии. // Зоол. журн. Т.81. Вып. 3. С. 276-284.
- Колобов М.Ю., Бурковский И.В., 2002а. Зимнее состояние сообщества как фаза годового цикла в развитии беспозвоночных на литорали Белого моря // Успехи совр. биол. Т. 122. Вып. 3. С. 222-226.
- Колобов М.Ю., Бурковский И.В., 2002b. Микропространственная организация популяций Priapulus caudatus и Halicryptus spinulosus (Priapulida) в градиенте мареографического уровня // Зоол. журн., в печати.
- Свирежев Ю.М., 1987. Нелинейные волны, диссипативные структуры и катастрофы в экологии. М.: Наука. 368 с.
- Allee W.C., 1951. Cooperation among animals with human implications. N.Y.: Shuman. 233 p.
- Andrewartha H.G., Birch L.C., 1954. The distribution and abundance of animals. Univ. Of Chicago Press, Chicago, 782 pp.
- Bonney A.P. 1975. Phytoplancton. London: Edward Arnold. 212 p.
- Fisher R.A., 1937. The wave of abvance of advantageousgenes // An. Eugenics. No.7. P. 355-369.
- Hutchinson G.E., 1959. Homage to Santa Rosalia, or why are there so many kinds of animals? // Amer. Natur. V. 93. P. 145-159.
- Kaitala V., Ranta E., Lindstrom J., 1996. Ciclic population dynamics and random perturbations. // J. Anim. Ecol. V. 65, No. 2. P. 249-251.
- Masing V.V., 1981. The dinamics of bog ecosystems and water bodies // Proc. Int. Sci. Work-shop on Ecosystem Dynamics in Freshwater Wetland, USSR. 1981. Moscow.: CIP. V.1. P.22-36.

 Морские рыбки
Морские рыбки
 Пресноводные рыбки
Пресноводные рыбки
 Террариумные животные
Террариумные животные
 Аквариумы и тумбы
Аквариумы и тумбы Каталог товаров
Каталог товаров Терарриумы
Терарриумы